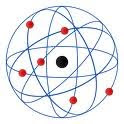
Es una descripción de las características y conformación de la anteriormente denominada “unidad constitutiva de la materia”, es decir, del átomo. Este concepto ha tenido grandes cambios, sobre todo por el descubrimiento de partículas subatómicas: el electrón (1895), el protón (1900) y el neutron (1920); que llevaron a revaluar la antigua concepción de átomo. De esta manera, se plantearon distintos modelos atómicos que proponían una visión de la estructura del átomo:
1.1. MODELO DE THOMSON:
1.2. MODELO DE RUTHERFORD:
1.3. MODELO DE BOHR:
1.4. MODELO DE LA MECANICA CUANTICA:
2. DISTRIBUCION ELECTRONICA Y VALENCIA:
La distribución electrónica hace referencia a la forma en la que se ubican los electrones en los orbitales atómicos siguiendo un aumento de energía:
Los electrones de valencia se entienden como los que están localizados en el ultimo nivel energético. Éstos se caracterizan por ser los que presentan mayor cambio de posición en el átomo, influyendo directamente en su reactividad.
3. ORBITALES ATOMICOS, HIBRIDACION Y GEOMETRIA MOLECULAR:
Los orbitales atómicos se definen como regiones espaciales en las cuales se encuentran alojados pares de electrones según la “regla de exclusión de Pauli”, y los cuales quedan totalmente definidos por tres números cuanticos: el principal (n), el azimutal (l) y el magnético (ml):
La hibridación es una combinación de orbitales atómicos para la formación de nuevos con características similares entre ellos pero distintas a las de los iniciales:
1orbital s + 1 orbital p = 2 orbitales sp
1 orbital s + 2 orbitales p = 3 orbitales sp2
1 orbital s + 3 orbitales p = 4 orbitales sp3
1 orbital s + 3 orbitales p + 1 orbital d = 5 orbitales sp3d
orbital s + 3 orbitales p + 2 orbital d = 6 orbitales sp3d2
hibridaciones
La geometría molecular es consecuencia de la hibridación de orbitales, pues las moléculas buscan conformar una estructura tridimensional simétrica disminuyendo las repulsiones entre los pares de electrones de los orbitales atómicos:
sp = lineal
sp2= trigonal plana
sp3= tetraédrica
sp3d= bipiramidal trigonal
sp3d2= octaédrica.
4. ENLACE QUIMICO: (FUERZAS INTRAMOLECULARES).
Es una interacción fuerte entre átomos que comparten o ceden electrones con el fin de alcanzar una configuración estable. Dicha configuración es la que se logra cuando alrededor de cada átomo hay 8 electrones (octeto).
4.1. ENLACE COVALENTE: se comparten electrones entre átomos cuya diferencia de electronegatividad menor que 1.7. (No metal + no metal)
4.2. ENLACE IONICO: se ceden o transfieren completamente electrones. La diferencia de electronegatividad es mayor a 1.7. (Metal + no metal)
4.3. ENLACE METALICO: es la unión entre elementos metálicos.
5. FUERZAS INTERMOLECULARES:
Son interacciones débiles entre moléculas, las cuales pueden ser de atracción o repulsión.
5.1. FUERZAS DE DISPERSION: son las mas débiles y se presentan entre cualquier tipo de compuestos.
5.2. FUERZAS DIPOLO-DIPOLO: se presentan entre moléculas polares.
5.3. FUERZAS ION-DIPOLO: se dan entre una carga positiva o negativa y una molécula polar.
5.4. PUENTES DE HIDROGENO: son atracciones entre átomos electronegativos e hidrógenos unidos a otro átomo electronegativo (F,N,O).
6. PROPIEDADES PERIODICAS:
Son características generales que se presentan en los átomos de la tabla periódica.
6.1. RADIO ATOMICO: distancia entre el núcleo y la capa externa del átomo.
6.2. ENERGIA DE IONIZACION: energía mínima para que un átomo pierda un electrón.
6.3. AFINIDAD ELECTRONICA: energía que libera un átomo cuando recibe un electrón.
6.4. ELECTRONEGATIVIDAD: tendencia de un átomo o molécula para atraer electrones.
6.5. POLARIDAD DE ENLACE Y MOLECULAS: es una medida de la ubicación de la nube electrónica por efecto de las electronegatividades involucradas. Esto puede ser en la ligadura o globalmente.
BIBLIOGRAFIA Y CIBERGRAFIA:
-Brown, T.L., Lemay, H.E. y Bursten. B.E. Quimica. La ciencia central. 7 ed. Mexico Ed pretice Hall. 1998.
-orbitales atomicos.[en linea].http://www.google.com.co/images?um=1&hl=es&rlz=1R2ADSA_esCO377&q=orbitales%20atomicos&ie=UTF-8&source=og&sa=N&tab=wi.[agosto 29 de 2010].
-configuracion electronica.[en linea].http://www.google.com.co/images?um=1&hl=es&rlz=1R2ADSA_esCO377&tbs=isch%3A1&sa=1&q=distribucion+electronica&aq=0&aqi=g3&aql=&oq=distribucion+el&gs_rfai=.[agosto 29 de 2010].
-modelo mecanica cuantica.[en linea].http://www.google.com.co/images?um=1&hl=es&rlz=1R2ADSA_esCO377&tbs=isch%3A1&sa=1&q=modelo+de+la+mecanica+cuantica&aq=3&aqi=g1&aql=&oq=modelo+de+la+mec&gs_rfai=.[agosto 29 de 2010].
-modelo de bohr.[en linea].http://www.google.com.co/images?um=1&hl=es&rlz=1R2ADSA_esCO377&tbs=isch%3A1&sa=1&q=modelo+de+bohr&aq=f&aqi=g2&aql=&oq=&gs_rfai=.[agosto 29 de 2010].
-modelo de rutherford.[en linea].http://www.google.com.co/images?q=modelo+de+rutherford&um=1&hl=es&rlz=1R2ADSA_esCO377&tbs=isch:1&ei=6Q57TKLCJdKA4Qaa58n8BQ&sa=N&start=20&ndsp=20=.[agosto 29 de 2010].
-modelo de thomson.[en linea].http://www.google.com.co/images?hl=es&q=modelo%20de%20thomson&rlz=1R2ADSA_esCO377&um=1&ie=UTF-8&source=og&sa=N&tab=wi.[agosto 29 de 2010].
-hybrid orbital formation.[en linea].http://www.youtube.com/watch?v=SJdllffWUqg.[agosto 29 de 2010].